The Myth of the Free Market for Pharmaceuticals
L'article d'en Conti, Frank i Cutler em va passar per alt, va sortir fa un any a NEJM. Com que val la pena, el repasso avui. Va sobre una qüestió que comparteixo plenament i és prou coneguda. El títol ho diu tot, el lliure mercat de medicaments és un mite. Jo fa temps que també ho vaig dir en aquest blog, i els que em seguiu ja ho sabeu.
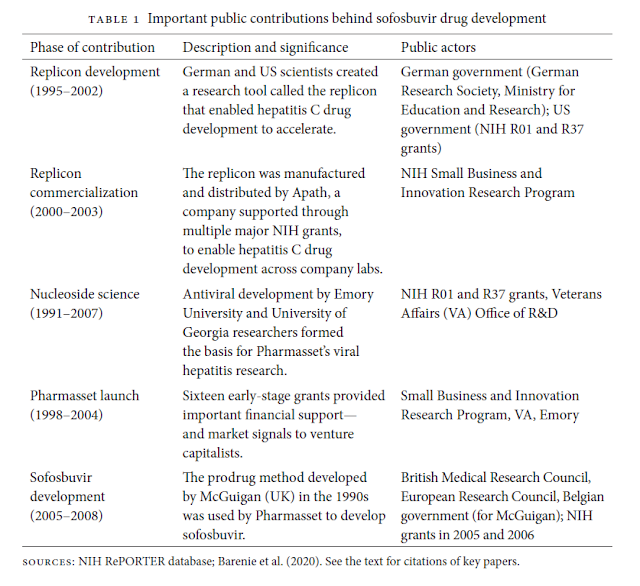
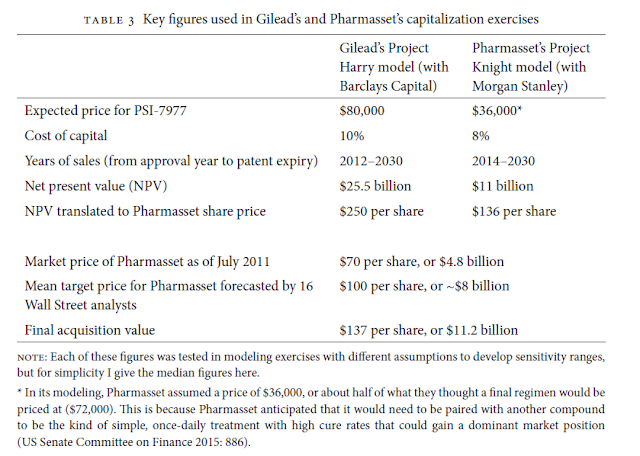
El missatge és clar i queda resumit en aquest quadre, per guardar.
Resumeixo l'article amb IA, cal que tingueu en compte que es basa en els USA:
L'article "El mite del lliure mercat per als productes farmacèutics" argumenta que el mercat farmacèutic modern dels Estats Units no compleix les característiques d'un mercat lliure. Segons els principis econòmics, en un mercat lliure, els consumidors estarien completament informats i prendrien decisions basades en els beneficis i costos discernibles dels productes, els venedors podrien entrar lliurement als mercats i produir productes similars o idèntics, i els preus serien competitius i no modificats per la intervenció governamental.
L'article detalla com el mercat farmacèutic dels EUA s'allunya d'aquest ideal en diversos aspectes:
- Comportament del consumidor: Els pacients no estan completament informats i depenen dels metges per a les recomanacions de medicaments i de les asseguradores per determinar l'accés. Tot i que els metges tenen coneixements sobre les propietats clíniques dels medicaments, sovint desconeixen els seus costos i rarament avaluen el seu valor econòmic per als pacients en el moment de la prescripció. A diferència de les polítiques de la majoria dels països, els EUA permeten la publicitat de medicaments sense necessitat de discutir-ne el preu, i sovint aquesta publicitat és enganyosa. A més, la majoria dels consumidors estan assegurats, cosa que els fa menys sensibles als preus, i els metges, gestors de beneficis de farmàcia i plans de salut poden beneficiar-se de l'ús de medicaments més cars.
- Comportament del productor: El govern atorga patents a les empreses, establint un període de monopoli per a un medicament durant el qual no es poden vendre versions alternatives. Encara que les patents d'ingredients actius duren 20 anys, les empreses solen obtenir drets d'exclusivitat addicionals, cosa que potencialment estén els monopolis fins a 35 anys. A més, cap medicament es pot vendre sense complir els estàndards de qualitat de fabricació, seguretat i eficàcia, i sense acreditar aquestes característiques a la seva etiqueta, cosa que restringeix la competència.
- Preus: Les empreses que venen medicaments de marca tenen poder de fixació de preus de monopoli gràcies a les patents i als drets d'exclusivitat concedits pel govern. Les polítiques governamentals subvencionen els costos del descobriment i desenvolupament de nous medicaments. A més, les polítiques governamentals exigeixen que les empreses que venen medicaments proporcionin descomptes i rebaixes a compradors seleccionats o es retirin de la cobertura d'assegurances públiques. El resultat net d'aquestes desviacions de l'ideal de lliure mercat és que els preus són alts, cosa que compromet l'accessibilitat. Els Estats Units són el mercat més gran de medicaments i paguen els preus més alts del món. Algunes empreses augmenten considerablement els preus durant anys després del llançament. Per tant, els Estats Units afavoreixen els productors per sobre dels consumidors, permetent que la indústria s'apropiï més del que li pertoca del valor econòmic dels medicaments.
L'article també destaca les polítiques que s'han implementat per promoure l'accessibilitat:
- Medicaments genèrics i biosimilars: La política ha promogut l'accessibilitat accelerant la disponibilitat de medicaments genèrics de la mateixa qualitat, seguretat i eficàcia que els medicaments de marca i produïts per empreses competitives. La Llei de Competència de Preus de Medicaments i Restauració del Termini de Patents de 1984 va modificar les regulacions sobre patents i exclusivitat per facilitar la venda de medicaments genèrics, tot assegurant que els medicaments de marca tinguessin temps suficient per recuperar la seva inversió. Això ha resultat en un mercat de genèrics robust. El 2010, la Llei de Competència de Preus de Productes Biològics i Innovació va establir una via abreujada per a l'aprovació de biosimilar per fomentar la competència en el sector dels biològics.
- Expansió de la cobertura d'assegurances: La política també ha ampliat la cobertura d'assegurances per reduir els costos dels consumidors. La Llei de Modernització de Medicare del 2003 va establir la cobertura de Medicare per als medicaments dispensats per les farmàcies. La Llei d'Atenció Assequible (ACA) del 2010 va ampliar l'accés a l'assegurança a milions de pacients que abans no en tenien. Ambdues polítiques van reduir els costos de butxaca entre les persones acabades d'assegurar, i els beneficis de la indústria van créixer gràcies a l'augment de les vendes de medicaments.
- Suport governamental a la investigació i el desenvolupament: Tot i que les empreses privades introdueixen nous medicaments al mercat, el govern contribueix a la seva creació donant suport a la ciència bàsica subjacent i proporcionant subvencions i formació a investigadors que poden acabar treballant a la indústria. La ciència del descobriment i desenvolupament de fàrmacs s'ha tornat més complexa, arriscada i costosa, i s'està duent a terme més investigació i desenvolupament gràcies a aquest suport governamental. La Llei de Medicaments Orfes del 1993 va proporcionar incentius financers per atraure l'interès de la indústria en medicaments per a malalties rares, inclosos períodes d'exclusivitat ampliats i crèdits fiscals de fins al 50% per a les despeses d'investigació i desenvolupament. Més del 50% dels nous medicaments ara s'aproven amb indicacions per a malalties orfes. El Projecte del Genoma Humà, la iniciativa Cancer Moonshot i la Llei de Cures subvencionen els costos de les empreses privades, contribuint al desenvolupament de la medicina de precisió.
L'article se centra especialment en la Llei de Reducció de la Inflació (IRA) com la política més recent destinada a millorar l'accessibilitat dels medicaments per a Medicare, els seus beneficiaris i els contribuents. Els canvis de política anteriors no havien aconseguit reduir els preus generals dels medicaments, només la porció que paguen els consumidors. Medicare paga preus molt més alts pels medicaments de marca que els plans estatals de Medicaid, altres compradors governamentals i els pagadors públics internacionals. Els preus elevats de Medicare causen problemes d'accessibilitat per als beneficiaris que requereixen tractament i per als contribuents. A diferència de les asseguradores comercials nord-americanes i els pagadors d'altres països, Medicare paga els medicaments fins i tot quan les proves suggereixen que tenen un benefici limitat o poden no ser rendibles.
La IRA aborda algunes d'aquestes preocupacions. Potser el més controvertit és que dona a Medicare autoritat per negociar els preus d'alguns medicaments de marca cars. Les negociacions amb les empreses participants per al primer grup de medicaments van començar el 2023, i els preus negociats entraran en vigor el 2026. Els 10 primers medicaments elegibles per a la negociació són utilitzats per uns 9 milions de beneficiaris per a afeccions com ara coàguls de sang, diabetis, malalties cardiovasculars, insuficiència cardíaca i malalties autoimmunes, i van representar 50.500 milions de dòlars en despeses de la Part D entre juny de 2022 i maig de 2023. També van representar 3.400 milions de dòlars en despeses de butxaca per als beneficiaris el 2022. Medicare seleccionarà per a la negociació medicaments addicionals coberts per la Part D per al 2027, fins a 15 medicaments coberts per la Part D o B per al 2028, i fins a 20 medicaments coberts per la Part D o B cada any a partir de llavors.
La negociació té com a objectiu retornar part del poder de negociació als contribuents perquè Medicare pagui per determinats medicaments amb períodes d'exclusivitat de mercat prolongats preus més propers als que es podrien pagar en un mercat que funcionés millor. Les reduccions previstes són del 30 al 70% dels preus actuals. Els mètodes de negociació de la IRA són similars als utilitzats per l'Administració de Veterans, el Departament de Defensa, les agències estatals de Medicaid i altres països per obtenir preus assequibles dels medicaments. En dirigir-se a medicaments de marca de llarga durada que representen una despesa elevada, la IRA pretén obtenir efectes similars als de les polítiques que promouen l'estalvi de costos mitjançant la competència de medicaments genèrics o biosimilars. Els medicaments inicials seleccionats per a la negociació van obtenir ingressos acumulats després del llançament que van superar amb escreix els seus costos de desenvolupament.
Algunes empreses ja han evitat la negociació permetent que es produeixi la competència de genèrics i biosimilars. La IRA també limita els augments de preus dels medicaments de marca a la taxa d'increment de l'índex de preus al consum, imposant a Medicare una restricció que ja opera en els plans estatals de Medicaid i alguns altres països.
La IRA deixa àmplies oportunitats per a la rendibilitat de les empreses, mantenint els incentius per invertir en nous medicaments. No restringeix els preus de llançament i limita la negociació a medicaments sense competidors significatius. També limita els costos de butxaca per als productes de preu elevat, inclosos els medicaments per a la diabetis i les malalties cardiovasculars, cosa que impulsarà les seves vendes; i elimina els costos de butxaca per a les vacunes per a adults. Eximeix de la negociació els medicaments que només estan aprovats per tractar malalties rares. I duplica el crèdit fiscal per a la investigació i el desenvolupament per a les petites empreses farmacèutiques i n'amplia les condicions d'ús.
L'efecte net esperat d'aquestes reformes és una desacceleració de la despesa en medicaments per part de Medicare i els seus beneficiaris, sense efectes substancials en els ingressos de les empreses ni en els incentius per a la innovació. Les asseguradores comercials i els empresaris també poden beneficiar-se incorporant els preus negociats dels medicaments a les seves polítiques.
L'article conclou que el mercat farmacèutic nord-americà sempre ha estat una construcció del govern, no un mercat lliure. La política governamental té com a objectiu establir regles que promoguin l'accés ampliat i una millor assequibilitat, alhora que donen suport al desenvolupament de nous medicaments que millorin la salut dels pacients i de la població. La IRA és la darrera política que intenta equilibrar aquests objectius i no serà la darrera.
PS. Per cert, som a 25 de març i encara no s'ha publicat l'informe d'execució pressupostària de tancament del 2024!!! I no passa res...