The NIH-Moderna Vaccine: Public Science, Private Profit, and Lessons for the Future
He insistit moltes vegades en la qüestió. Però malauradament, les evidències d'apropiació privada dels resultats segueixen en entorns on el finançament públic es preeminent. Avui un article explica el cas de ModeRNA.
Resum de l'article amb IA
El comentari "The NIH-Moderna Vaccine: Public Science, Private Profit, and Lessons for the Future" de Christopher J. Morten analitza la història de la vacuna NIH-Moderna contra la COVID-19 des de quatre perspectives: financera, legal, político-econòmica i científica, i argumenta que **Moderna va capturar el valor creat amb fons públics**. El document identifica errors de les administracions Trump i Biden i ofereix tres recomanacions per al futur: millors contractes amb fabricants farmacèutics, millors incentius per a aquests fabricants i una "opció pública" sense ànim de lucre per al desenvolupament farmacèutic.
Aquí hi ha un resum dels punts clau de l'article:
**Desriscament sense precedents:** El govern dels EUA, i no Moderna, va proporcionar capital substancial i va assumir gran part del risc en el desenvolupament de la vacuna. El govern va signar un contracte de compra de 1.500 milions de dòlars per 100 milions de dosis de la vacuna, que semblava comprometre el govern a pagar a Moderna encara que la vacuna mai no obtingués l'autorització o l'aprovació de la FDA. També es va intentar blindar Moderna de qualsevol responsabilitat per infringir patents d'altres empreses.
**Captura privada de valor públic:** Malgrat les inversions substancials del govern i l'assumpció de riscos, Moderna i els seus executius i accionistes van capturar el valor produït per aquesta col·laboració público-privada. **Moderna va decidir quintuplicar els seus preus, d'uns 25 dòlars per dosi a 130 dòlars**.
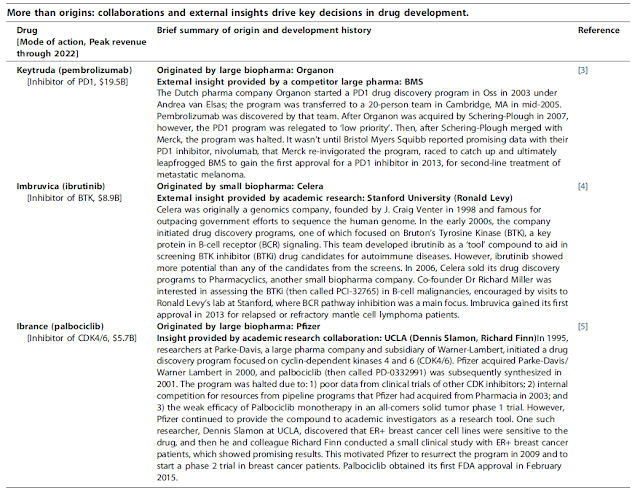
**Perspectiva científica:** L'article destaca que **Moderna no va inventar cap de les tres característiques científiques clau de la vacuna**: l'immunogen, l'ARNm modificat i el sistema d'administració. L'immunogen va ser inventat per un equip de científics de l'NIH finançats amb fons públics. L'ARNm modificat va ser creat per investigadors de la Universitat de Pennsilvània amb el suport de l'NIH. El sistema d'administració va ser inventat i desenvolupat inicialment per investigadors afiliats a la Universitat de la Colúmbia Britànica. L'NIH també va dissenyar, pagar i dur a terme els primers assajos clínics. Tot i que els científics de Moderna van fer contribucions importants a la vacuna, la història científica soscava els esforços dels executius de Moderna per reclamar el valor complet de la vacuna.
**El poder reduït del govern:** El govern dels EUA va passar de ser soci de Moderna a ser un client indefens. Una carta de juliol de 2023 del secretari de Salut i Serveis Humans a Moderna i Pfizer mostra la impotència del govern davant els increments de preus. Les conseqüències probables dels preus elevats són: augment de la desigualtat, costos de salut pública i més malaltia i mort per COVID-19.
**Recomanacions per al futur:** L'article ofereix diverses recomanacions per evitar que aquest escenari es torni a produir:
**Millors contractes:** S'han de crear contractes amb condicions de preus justos i accés global, compromisos per a la compartició de dades i representants del govern en els consells corporatius.
**Millors incentius:** S'han d'experimentar amb estructures d'incentius alternatives com els premis a la innovació i els models de col·laboració "de propietat governamental, gestionats per contractistes" (GOCO).
**Opció pública:** Es necessita una "opció pública" que inclogui investigació i desenvolupament farmacèutic de propietat i gestió governamentals, centrada en la salut pública i l'avanç del coneixement humà.
L'article també assenyala que el govern va perdre l'oportunitat d'utilitzar la seva patent clau sobre l'immunogen com a palanca financera per obtenir concessions de l'empresa. El govern podria haver utilitzat la Llei de Producció de Defensa per obligar Moderna a compartir informació sobre la fabricació de la vacuna d'ARNm amb l'Organització Mundial de la Salut.
**Reformes:** L'article assenyala la necessitat d'un nou marc legal i polític per a les col·laboracions público-privades. El govern hauria d'invertir en la investigació i el desenvolupament i alhora explorar la possibilitat de desenvolupar productes farmacèutics sense dependre de la indústria farmacèutica. Les noves inversions i iniciatives en investigació i desenvolupament ofereixen una oportunitat per a la reforma.
En conclusió, el comentari destaca la importància de les inversions públiques per al desenvolupament de vacunes i la necessitat de **protegir aquestes inversions de la captura privada**, alhora que emfatitza la necessitat de més transparència, contractes millor negociats i la participació del govern en el desenvolupament de productes farmacèutics per garantir l'accés global i els preus justos.
Pilar Aymerich. Borsa BCN