Editando genes: recorta, pega y colorea
El llibre "Editando genes: recorta, pega y colorea" de Lluís Montoliu és una obra de divulgació científica que ofereix una visió bàsica i assequible sobre l'edició genètica, amb un èmfasi especial en les eines CRISPR. L'autor, Lluís Montoliu, és un investigador pioner en l'ús i la disseminació d'aquestes eines a Espanya. El llibre busca ressaltar tant els avantatges com les limitacions i problemes no resolts associats a aquests mètodes, per tal d'oferir al lector una visió honesta i realista del que es pot esperar d'aquesta revolució tecnològica.
A continuació, es resumeix detalladament el llibre:
I. El Conceepte de Serendipitat i els Orígens de CRISPR
- La Serendipitat en la Ciència: El llibre destaca la importància de la serendipitat (o "chiripa") en els descobriments científics, definida com topar-se amb quelcom inesperat i adonar-se de la seva rellevància. Montoliu aplica aquest concepte al seu propi camí cap a les CRISPR i al seu encontre amb Francis Mojica, així com a l'escriptura del llibre.
- El Descobriment de Francis Mojica:
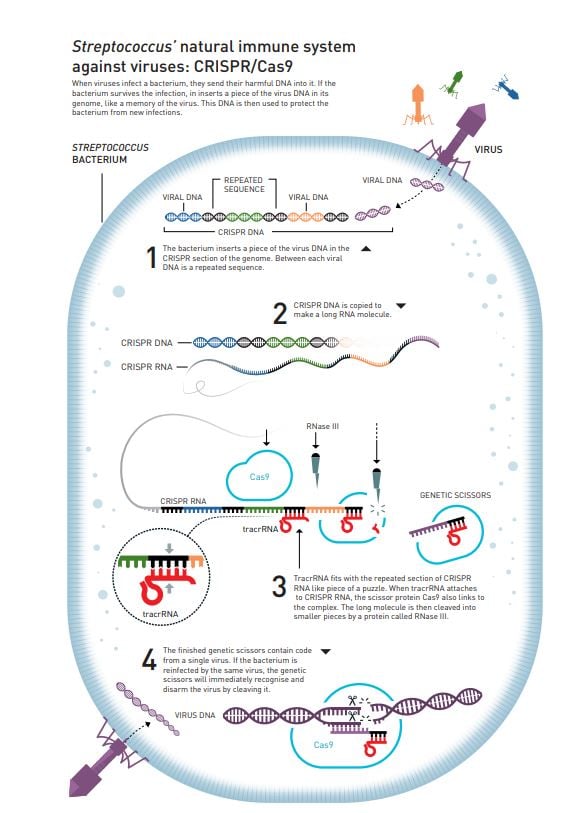
- La història de les CRISPR, tot i que avui popularitzades, es remunta a 1987 al Japó amb Atsuo Nakata i Yoshizumi Ishino, que van documentar per primera vegada repeticions de seqüències d'ADN. Dos anys després, Nakata en va reportar de similars en altres bacteris. El 1991, microbiòlegs holandesos van descobrir-ne de similars en Mycobacterium tuberculosis, anomenant-les "DR" (direct repeats) i utilitzant-les per diferenciar ceps.
- No obstant això, la observació més important es va fer a Alacant per part de Francisco Juan Martínez Mojica (Francis Mojica) a principis dels anys noranta, durant la seva tesi doctoral a la Universitat d'Alacant. Mojica va descobrir aquestes repeticions en l'arquea Haloferax mediterranei.
- A diferència dels seus predecessors, Mojica es va adonar de la rellevància evolutiva d'aquestes repeticions en organismes tan diferents i va decidir dedicar la seva carrera a desxifrar la seva funció.
- L'any 2000, Mojica va publicar un dels primers estudis comparatius d'aquestes seqüències, anomenant-les "SRSR" (short regularly spaced repeats).
- L'any 2001, Mojica va arribar a un acord amb el microbiòleg holandès Ruud Jansen per anomenar aquestes repeticions CRISPR (clustered regularly interspaced short palindromic repeats), un acrònim que va inventar el mateix Mojica i que va triomfar per la seva sonoritat i singularitat. Jansen va ser el primer a utilitzar el terme "CRISPR" en una publicació científica el 2002, on també va anomenar els gens associats "Cas" (CRISPR-associated genes).
- El 2003, Mojica va fer el seu descobriment més rellevant: les seqüències espaciadores entre les repeticions CRISPR eren fragments del genoma de virus i plasmidis invasors. Això el va portar a proposar que les CRISPR eren un sistema de defensa immune adaptatiu en procariotes. Aquest article, inicialment rebutjat per revistes de gran impacte, es va publicar finalment el 2005 al Journal of Molecular Evolution, marcant l'inici de la revolució CRISPR.
- Confirmació Experimental i Evolució del Sistema:
- El 2007, Rodolphe Barrangou i col·laboradors van confirmar experimentalment la hipòtesi de Mojica, demostrant que les CRISPR funcionaven com a sistema de defensa contra virus en Streptococcus thermophilus.
- El 2008, John van der Oost va descobrir les molècules d'ARN guia (crRNA) que eren essencials per dirigir la resposta antiviral.
- El 2010, Sylvain Moineau va integrar tot el coneixement per explicar el mecanisme del sistema CRISPR.
- El 2011, Emmanuelle Charpentier va descobrir una altra molècula d'ARN clau, la tracrRNA.
- La Transformació en Eina d'Edició Genètica:
- L'estiu de 2012, la col·laboració entre Emmanuelle Charpentier i Jennifer Doudna va cristal·litzar en un article a Science que va descriure els components del sistema CRISPR-Cas9 d'Streptococcus pyogenes i va proposar el seu ús potencial com a eina d'edició genètica programable per ARN. Aquest treball és considerat l'origen de la revolució CRISPR i va merèixer el Premi Nobel de Química el 2020 a ambdues investigadores.
- Virginijus Siksnys, de Lituània, va tenir una idea similar i va enviar un article amb propostes semblants abans que Doudna i Charpentier, però la lentitud del procés editorial va fer que el seu treball es publiqués mesos després, a PNAS, el setembre de 2012.
- La demostració experimental que les CRISPR podien editar el genoma de cèl·lules de mamífer (humanes i de ratolí) va arribar el gener de 2013, amb la publicació simultània dels laboratoris de Feng Zhang (Broad Institute) i George Church (Harvard University) a Science. Marc Güell, un investigador espanyol, va ser coautor d'un dels primers treballs de Church.
- El maig de 2013, el laboratori de Rudolf Jaenisch (Whitehead Institute) va ser pioner en generar els primers ratolins editats genèticament amb CRISPR.
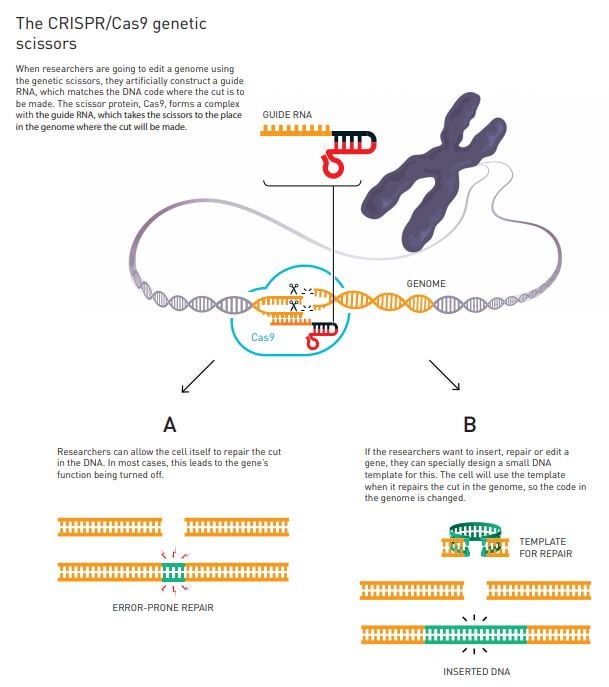
II. Mecanisme de l'Edició Genètica: "Recorta, Pega y Colorea"
- El Procés Bàsic: L'edició genètica amb CRISPR-Cas9 es basa en la capacitat de la nucleasa Cas9 de tallar l'ADN en posicions precises, guiada per una petita molècula d'ARN guia. Aquest tall requereix una seqüència característica anomenada PAM (protospacer adjacent motif), que va ser inventada per Francis Mojica el 2009.
- Reparació de l'ADN: Després del tall, la cèl·lula activa els seus mecanismes de reparació de l'ADN, que poden seguir dues rutes principals:
- Unió d'Extrems No Homòlegs (NHEJ): També anomenada "ruta del velcro" o "cremallera" o "ruta sucia", és la via per defecte que introdueix insercions o delecions (INDEL) aleatòries de nucleòtids en la zona del tall. Aquesta via sol portar a la inactivació del gen.
- Reparació Dirigida per Homologia (HDR): Si es proporciona a la cèl·lula una seqüència d'ADN motlle similar a la zona del tall però amb les modificacions desitjades, la cèl·lula pot utilitzar-la per reparar-se de manera controlada, editant el genoma a voluntat. Aquesta és la "ruta neta".
- Metàfora "Recorta, Pega y Colorea":
- "Recorta" es refereix a l'acció de la Cas9 de tallar l'ADN.
- "Pega" fa al·lusió als sistemes de reparació cel·lular que reconstrueixen l'ADN després del tall.
- "Colorea" es refereix a la capacitat d'activar o silenciar gens, o fins i tot de "pintar" estructures genètiques.
III. Limitacions i Desafiaments de la Tecnologia CRISPR
- Mutacions Fora de Diana (Off-target): Una de les limitacions de CRISPR-Cas9 és la possibilitat de realitzar talls no desitjats en seqüències del genoma que, tot i no ser la diana principal, tenen similituds amb l'ARN guia. Això pot provocar mutacions no intencionades. S'ha millorat la Cas9 amb variants com la "enhanced" (eSpCas9) o "high-fidelity" (HF-SpCas9) per reduir aquest risc.
- Mosaicisme Genètic (On-target Variability): Els sistemes de reparació de l'ADN generen una gran variabilitat de resultats (INDELs) en el lloc del tall, fins i tot en la diana prevista. Això implica que les cèl·lules o organismes resultants poden ser un "mosaic" de diferents edicions genètiques. Aquest és un problema important per a aplicacions terapèutiques en humans.
- Resposta Immunitària a Cas9: La majoria de les persones ja tenen anticossos (79% contra SaCas9 i 65% contra SpCas9) i limfòcits T (46%) contra les proteïnes Cas9 derivades de bacteris comuns. Això suposa un risc de reaccions al·lèrgiques o immunitàries severes en teràpies in vivo.
- Activitat de p53: La proteïna p53, coneguda com la "guardiana del genoma", s'activa davant els talls de doble cadena a l'ADN, contrarestant l'acció de Cas9 i disminuint l'eficiència de l'edició. Això fa que sigui més difícil editar el genoma en cèl·lules amb alta activitat de p53, tot i que p53 és essencial per prevenir tumors.
IV. Aplicacions de les CRISPR
El llibre explora un ampli ventall d'aplicacions, destacant aquelles que abans eren impossibles o extremadament difícils:
- Estudi del Genoma No Codificant ("ADN Brossa"): CRISPR ha estat clau per investigar la part més gran del nostre genoma (98%), el genoma no codificant o intergènic, que conté elements reguladors essencials per a l'expressió dels gens. S'ha demostrat, per exemple, com la mutació d'un element regulador del gen Sonic hedgehog (Shh) pot explicar la falta d'extremitats en serps.
- Modulació Epigenètica: Mitjançant variants de Cas9 "mortes" (dCas9) unides a altres proteïnes, es pot "colorear" el genoma, activant o silenciant gens sense tallar l'ADN. Exemples inclouen la reactivació de la globina fetal per tractar l'anèmia falciforme, o la desmetilació del gen FMR1 per tractar el Síndrome de l'X Fràgil. També es menciona la tècnica CRISPRainbow per visualitzar gens.
- Modelització de Malalties Humanes (Ratolins Avatar): Les CRISPR permeten crear ratolins avatar, que reprodueixen exactament les mateixes mutacions genètiques que es troben en pacients humans amb malalties rares. Això és crucial per a la medicina personalitzada, ja que permet validar la seguretat i eficàcia de tractaments específics per a mutacions concretes abans d'aplicar-los en pacients.
- Millora Animal i Ramaderia: L'edició genètica permet millorar característiques animals de manera molt més ràpida i precisa que la millora genètica tradicional. Exemples inclouen:
- Porcs resistents a malalties: Modificació del gen RELA per resistència a la pesta porcina africana o eliminació de CD163 per resistència al virus PRRSV.
- Vaques sense banyes: Introducció de la mutació natural POLLED de la raça Angus en vaques Holstein. Tot i que un intent inicial va ser problemàtic per la inserció no desitjada d'un plasmidi bacterià.
- Ovelles hipermusculades: Inactivació del gen MSTN per augmentar la massa muscular en ovelles Merina, similar a la raça Texel.
- Xenotrasplantaments: Desenvolupament de porcs amb òrgans més segurs per a trasplantaments a humans, eliminant retrovirus endògens porcins (PERV) mitjançant CRISPR.
- Control de Plagues (Gene Drive): Una aplicació "escalofriant" que desafia les lleis de Mendel. La tècnica de "gene drive" (impuls gènic) permet que un al·lel mutat s'expandeixi ràpidament i de manera dominant en una població, forçant la modificació de la majoria d'individus. Això té un enorme potencial per controlar malalties transmeses per mosquits com la malària, fent-los estèrils o incapaces de transmetre el paràsit. No obstant, planteja seriosos dilemes de bioseguretat i repercussions ecològiques.
- Diagnòstic (SHERLOCK i DETECTR): Feng Zhang va desenvolupar SHERLOCK (Specific High Sensitivity Enzymatic Reporter Unlocking), un sistema de diagnòstic basat en CRISPR que utilitza Cas13a per detectar ARN (o ADN prèviament transcrit a ARN) amb una sensibilitat extremadament alta. Jennifer Doudna va desenvolupar un sistema similar anomenat DETECTR basat en Cas12a. Aquests sistemes permeten diagnòstics ràpids i de baix cost, fins i tot en paper reactiu.
- Edició d'ARN (REPAIR): Feng Zhang també va ser pioner en el desenvolupament de CRISPR 2.0, eines que poden editar directament l'ARN sense modificar l'ADN original. La tecnologia REPAIR (RNA Editing for Programmable A to I Replacement) permet convertir A en I (que la cèl·lula interpreta com G) amb alta especificitat, oferint una via més segura per a teràpies gèniques.
- Emmagatzematge d'Informació en ADN Bacterià: George Church va demostrar la sorprenent capacitat d'utilitzar bacteris (Escherichia coli) com a "memòries USB" per emmagatzemar dades, codificant fotogrames de pel·lícules en el seu genoma mitjançant CRISPR i recuperant-los posteriorment mitjançant seqüenciació.
V. Consideracions Ètiques, Legals i Socials
- Edició Genètica en Embrions Humans (Teràpia Germinal):
- La possibilitat d'editar embrions humans va generar un intens debat des del 2013.
- El 2015, un article d'opinió a Science per part de prestigiosos investigadors va desaconsellar l'edició genètica d'embrions humans amb fins clínics, demanant prudència i un debat internacional.
- El mateix any 2015, un equip xinès va publicar el primer experiment d'edició genètica en embrions humans anòmals (triplonuclears, no viables). Els resultats van mostrar baixa eficiència, mosaicisme i mutacions no desitjades, confirmant les limitacions de la tècnica i la imprudència de la seva aplicació clínica en aquell moment.
- La Cimera Internacional de Washington (desembre 2015) va promoure la investigació de teràpies somàtiques (sense impacte en la descendència) i va concloure que l'edició d'embrions humans era "prematura" i "irresponsable" per a la clínica, tot i no prohibir-la explícitament a EUA.
- El Conveni d'Astúries (1997), ratificat per la majoria de països europeus (incloent Espanya), prohibeix explícitament la modificació genètica del genoma humà que pugui transmetre's a la descendència (Article 13), inhabilitant la teràpia germinal.
- L'estudi de Shoukhrat Mitalipov (2017) a Nature va generar controvèrsia en reportar una alta eficiència en la correcció d'una mutació en embrions humans mitjançant CRISPR. No obstant, altres grups van qüestionar aquests resultats, suggerint que la "correcció" podria ser en realitat delecions no detectades o embrions partenogenètics. La conclusió de Montoliu és que l'edició germinal segueix sent "prematura, imprudent, insegura, irresponsable, innecessària i, per a molts països, il·legal".
- Els "Bebès de Disseny" de He Jiankui:
- El llibre relata el cas de He Jiankui (novembre 2018), l'investigador xinès que va anunciar el naixement de les bessones Lulu i Nana amb el gen CCR5 editat mitjançant CRISPR. La seva intenció era fer-les resistents al VIH.
- L'anàlisi del manuscrit de He Jiankui va ser "demolidora", revelant que els embrions eren mosaics, les mutacions detectades eren diverses i desconegudes en humans, i cap d'elles corresponia a la mutació delta32 planificada. A més, es van detectar mutacions no desitjades.
- Malgrat aquests resultats preocupants, He Jiankui va procedir a implantar els embrions, una decisió considerada una "greu imprudència", "risc" i "gran irresponsabilitat".
- Aquest cas va ser un "shock" i va provocar la seva condemna per part de la comunitat científica internacional.
- Teràpia Somàtica (en Adults): A diferència de la teràpia germinal, la modificació genètica de cèl·lules somàtiques (sense impacte en la descendència) és legal i prometedora. S'estan realitzant assajos clínics amb TALEN i ZFN per a càncer, SIDA, talassèmia i altres malalties. El primer tractament in vivo amb edició genètica va ser el novembre de 2017 amb ZFN per al síndrome de Hunter.
- Disputes de Patents: Els primers articles de CRISPR van generar una "tremendament negativa" conseqüència: disputes de patents entre institucions com la UC Berkeley (Doudna i Charpentier) i el Broad Institute del MIT (Zhang), que van portar a litigis interminables pels drets d'explotació comercial.
- Moviment "Do It Yourself" (DIY) CRISPR: La facilitat d'ús i el baix cost de CRISPR han portat a un moviment "fes-ho tu mateix". L'autor considera aquestes accions com una "soberana estupidez, una imprudència i una irresponsabilitat", advocant per una regulació estricta de l'accés als reactius d'edició genètica.
- Ètica i Responsabilitat Social: El llibre subratlla la importància del debat obert i la transparència en l'aplicació de CRISPR, involucrant la societat en la definició dels límits. L'associació ARRIGE (Association for Responsible Research and Innovation in Genome Editing) busca promoure una governança global i un ús èticament responsable de les tècniques d'edició genètica.
VI. Futur de l'Edició Genètica
Montoliu preveu tres àrees clau per al futur de CRISPR:
- Aplicació Massiva en Agricultura i Ramaderia: La capacitat de generar noves varietats amb propietats millorades de forma massiva.
- Editors de Bases i PRIME Editing:
- Editors de Bases: Desenvolupats per David Liu, permeten canviar una sola lletra de l'ADN (per exemple, C→T o A→G) sense tallar la doble cadena, minimitzant el mosaicisme i les mutacions no desitjades.
- PRIME Editing (Edició de Qualitat): També de David Liu, aquesta variant utilitza una Cas9 nickasa (talla una sola cadena d'ADN) i una retrotranscriptasa, combinades amb una guia d'ARN més llarga (pegARN), per introduir canvis precisos sense dependre dels sistemes de reparació cel·lular. Aquesta tecnologia té un gran potencial per tractar fins al 85% de les mutacions associades a malalties humanes.
- Diversitat dels Sistemes CRISPR en Procariotes: Encara hi ha un camp "verge" per explorar milions de nous sistemes CRISPR en bacteris i arquees, que podrien oferir eines amb propietats millors o més adequades per a aplicacions d'edició genètica. L'autor destaca la troballa de deu nous sistemes de defensa genètica en procariotes el 2018, més enllà de CRISPR.
En definitiva, "Editando genes" ofereix una història detallada i una anàlisi exhaustiva de la tecnologia CRISPR, des dels seus humils orígens en els laboratoris de microbiologia fins a la seva actualitat com a eina transformadora en biologia i medicina, sense defugir els complexos dilemes ètics i legals que planteja. Lluís Montoliu aposta per una ciència oberta i responsable que continuï la investigació bàsica per superar les limitacions actuals i assegurar que els beneficis d'aquesta "revolució tecnològica" arribin a la societat de manera segura i efectiva.